コラム
遺伝子工学は最強の生命科学である!?
地球上の生物は、ウイルスも含めて全て核酸(DNAまたはRNA)をゲノムとして持ち、塩基情報の中に生命のプログラムがコードされています。ゲノム編集を含めた遺伝子工学は言わば、この生物プログラムを自在に書き換える技術です。プログラミングが出来なくてもパソコンやスマホは使えますが、自分でプログラミングができれば、新しいソフトやアプリを開発して自在にパソコンやスマホを操ることが出来るようになりますよね?生命プログラムを理解することを生命科学とすれば、遺伝子工学はプログラミングに相当し、生命の作動根拠を操る、まさに最強の学問分野と言えるのでは無いでしょうか。
書かれているDNAプログラム言語は、シーケンサー技術の革新で大分読めるようになりました。しかし残念ながら、我々人間はこの生命プログラムが細胞の中でどの様に動いているのか、なぜ動けるのか、まだまだ分からない事だらけです。そして、遺伝子工学やゲノム編集が"自在に書き換える"と言っても、一度に書き換える事ができるのは、巨大な百科事典の中のほんの数単語だけです。それでも、書き換え(組換え)技術を改良し、改変する場所を厳選すれば、ごくごく一部ではありますが、生命プログラムを書き換えることが出来ます。また、この技術は遺伝子変異難病の治療にも繋がると考えています。
我々の究極の研究目標は難病の治療法開発ですが、塩基配列を書き換える遺伝子工学技術は、どんな生物を研究するにせよ使える技術です。生命の神秘が全て解き明かされない限り、これから数十年先でも遺伝子改変技術は廃れる事は無いでしょう。人類は未開の地を求めて宇宙にまで進出していますが、細胞の中のゲノムは、最も身近な未開の地だと考えています。これを切り開くために、遺伝子改変技術を極める必要があるのです。
遺伝子治療の現状と次世代のゲノム編集治療開発
日本で現在、一番高価な薬は「ゾルゲンスマ」で、2020年3月に承認されましたが、一度の投与分で1億6000万円です。これは脊髄性筋萎縮症(SMA)という小児難病に対する遺伝子治療薬で、アデノ随伴ウイルス(AAV)というほぼ無毒のウイルスを運び屋(ベクター)として治療用の遺伝子を送り届ける画期的な薬です。AAVウイルスベクターは投与後も細胞内に残るので、一回の投与で何年にも渡って効果が期待できるのが大きな特徴です。その他、2019年3月に承認された「キムリア」も一回3300万円の薬価が付きましたが、患者のT細胞にレンチウイルスベクターを用いて遺伝子導入することで、血液がんに対する攻撃能力を高めた遺伝子治療の一種です。
今後、色々な遺伝子治療薬が次々と市場に出て来ると予想され、遺伝子治療が普通の医療として実施される時代がついにやって来ました。しかし、遺伝子治療にはまだまだ改良の余地があります。例えば、AAVベクターは一度投与すると、免疫反応を誘導するため二回目の投与ができません。また、搭載可能な遺伝子サイズに限界があるため、疾患の原因遺伝子が大きすぎる場合には送達が困難になります。遺伝子機能が壊れて働かないだけであれば、外から代わりに治療用遺伝子を補充すれば治療できますが、遺伝子異常で毒性が出てしまう疾患であれば、遺伝子補充では無く、異常箇所を修復する必要があります。このような遺伝子を補充する遺伝子治療では治療できない疾患でも、ゲノム編集技術を使えば治療できる可能性があります。堀田研では遺伝子治療の次に「ゲノム編集治療」が来ると考えて、この実現に向けた研究に取り組んでいます。
堀田研究室のコンセプト
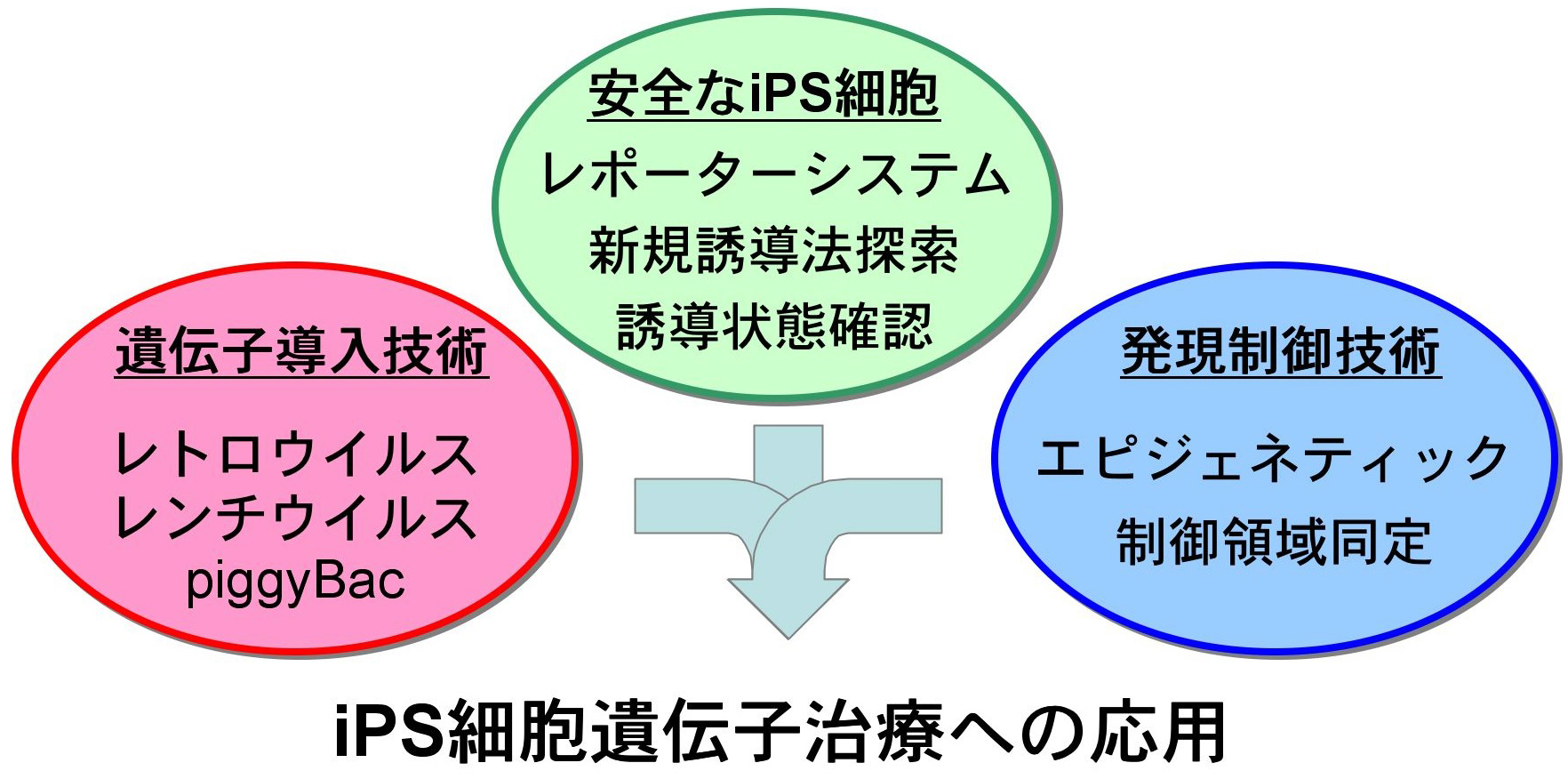 遺伝子の変異が原因で引き起こされる難病に対して、その根本原因である遺伝子変異を修復する遺伝子治療を実現させるためには、遺伝子変異や疾患の種類に応じて、様々な戦略を取る必要があります。我々の研究室では、ウイルスベクターや非ウイルスベクターを活用した遺伝子導入技術、CRISPR-Cas9などのゲノム編集技術を応用することで、これらの課題に挑戦しています。以下では、堀田研の主な研究内容について、最新のものから紹介しています。
遺伝子の変異が原因で引き起こされる難病に対して、その根本原因である遺伝子変異を修復する遺伝子治療を実現させるためには、遺伝子変異や疾患の種類に応じて、様々な戦略を取る必要があります。我々の研究室では、ウイルスベクターや非ウイルスベクターを活用した遺伝子導入技術、CRISPR-Cas9などのゲノム編集技術を応用することで、これらの課題に挑戦しています。以下では、堀田研の主な研究内容について、最新のものから紹介しています。
CRISPR-Cas9を用いたゲノム編集とは?
CRISPRとは、細菌由来のDNA切断システムの一種で、クラス1とクラス2に大別されます。1987年に石野良純先生が最初にcrRNA配列を発見したのは、大腸菌のクラス1CRISPRシステムでしたが、2012年になってゲノム編集ツールとして再認識され、以後広く活用されるようになったのは、化膿性レンサ球菌のクラス2CRISPRでした。これは、クラス2CRISPRが単一のタンパク質因子Cas9のみで構成されていて、複合体として機能するクラス1システムより取り扱いが楽だからです。クラス2のCas9システムは右図において、ターゲットDNA (赤色とオレンジ)にgRNA (ガイドRNA, 紫色)が結合することでゲノム上のターゲット配列を見つけ出し、Cas9タンパク質 (緑色)のDNA切断ドメインによって狙った部位にDNA切断を誘導します。DNA結合を担うgRNAを自在に組み替えることで、ヒトゲノム上の任意の位置にDNA損傷を誘導し、標的部位の塩基配列を欠損させたり、任意の配列を挿入することが可能です。
Cas9とgRNAを空のウイルス様粒子に内封して送達する技術: NanoMEDIC
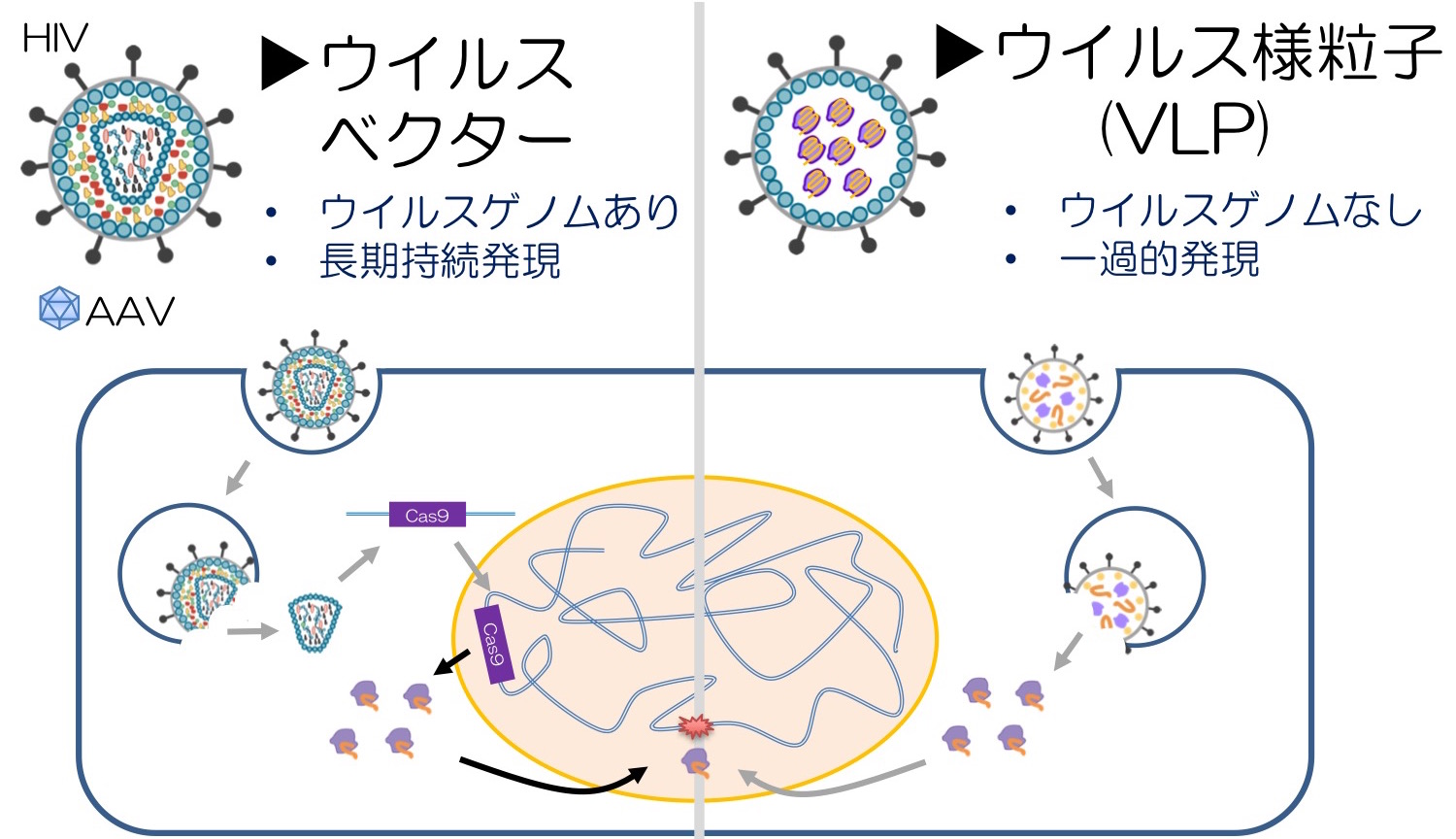 筋ジストロフィーなどの疾患の遺伝子変異を修復するためには、CRISPR-Cas9システムを細胞内部に導入する必要があります。その際のベクターとして、比較的高効率に導入・送達できるアデノ随伴ウイルス(AAV)ベクターやレンチウイルスベクターが遺伝子治療業界ではよく用いられます。しかし、AAVやレンチウイルスは導入してから数年以上発現が継続し、Cas9を発現させた場合のオフターゲット変異誘導リスクが懸念されています。そこで我々は、細胞膜から放出されるナノサイズのカプセル、ウイルス様粒子(VLP)に注目しました。遺伝子治療分野で古くから利用されてきたレンチウイルスベクターのウイルス遺伝子群を最大限除去することで作成されるVLPは、形状は一見ウイルスに似ていますが、ウイルスゲノムを包含せず、発現は一過的です。
筋ジストロフィーなどの疾患の遺伝子変異を修復するためには、CRISPR-Cas9システムを細胞内部に導入する必要があります。その際のベクターとして、比較的高効率に導入・送達できるアデノ随伴ウイルス(AAV)ベクターやレンチウイルスベクターが遺伝子治療業界ではよく用いられます。しかし、AAVやレンチウイルスは導入してから数年以上発現が継続し、Cas9を発現させた場合のオフターゲット変異誘導リスクが懸念されています。そこで我々は、細胞膜から放出されるナノサイズのカプセル、ウイルス様粒子(VLP)に注目しました。遺伝子治療分野で古くから利用されてきたレンチウイルスベクターのウイルス遺伝子群を最大限除去することで作成されるVLPは、形状は一見ウイルスに似ていますが、ウイルスゲノムを包含せず、発現は一過的です。
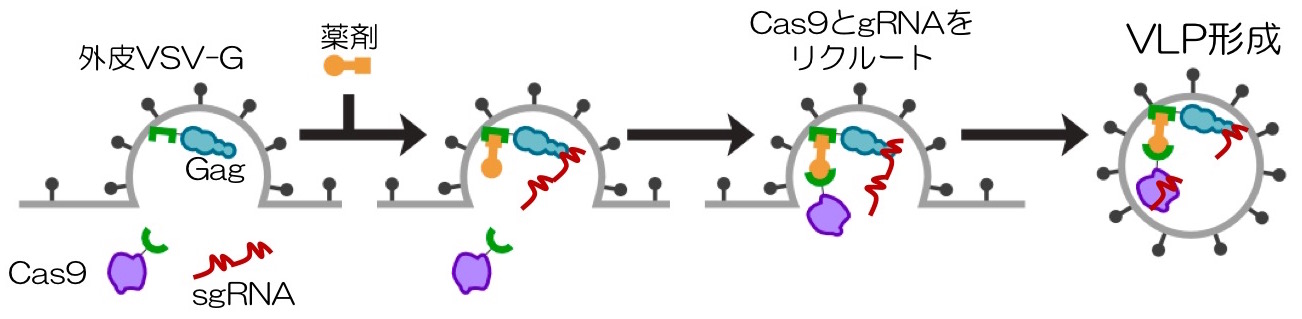
このVLP内部に、Cas9タンパク質と標的ゲノム配列を認識するガイドRNAを搭載するシステムを開発しました。具体的には、FRBタンパク質をCas9に連結し、FKBP12タンパク質Gagタンパク質に連結することで、K506類似体薬剤を添加すると、Cas9がGag粒子内部に呼び寄せられます。さらに、ガイドRNAもGagと結合するようにパッケージングシグナルを付与し、後に自己切断リボザイムでガイドRNAだけが切り出される様に工夫して、粒子内部にCas9とガイドRNAが封入されたVLPが産生されます。このシステムは、NanoMEDIC (NanoMembrane-derived Extracellular vesicles for Delivery of macromolecular Cargo)と名付けました。
 このNanoMEDICを用い、骨格筋細胞やiPS細胞、に添加した所、様々な遺伝子領域を高効率でゲノム編集を誘導することが出来ました。一般的に非分裂細胞への遺伝子導入は困難なのですが、iPS細胞由来神経細胞にも効率的に導入してゲノム編集を起こすことが出来ました。
このNanoMEDICを用い、骨格筋細胞やiPS細胞、に添加した所、様々な遺伝子領域を高効率でゲノム編集を誘導することが出来ました。一般的に非分裂細胞への遺伝子導入は困難なのですが、iPS細胞由来神経細胞にも効率的に導入してゲノム編集を起こすことが出来ました。
また、生体内への送達効率を検証するために、ヒトジストロフィン遺伝子のエクソンスキッピングが誘導されるとルシフェラーゼが発光するトランスジェニックマウスを作成しました。このマウスの後脚の骨格筋へNanoMEDICを一回だけ投与した所、160日以上にも渡ってゲノム編集によるエクソンスキッピング活性が維持されることを確認しました。同様のエクソンスキッピングは、mdxマウスモデルでも検出することが出来ました。
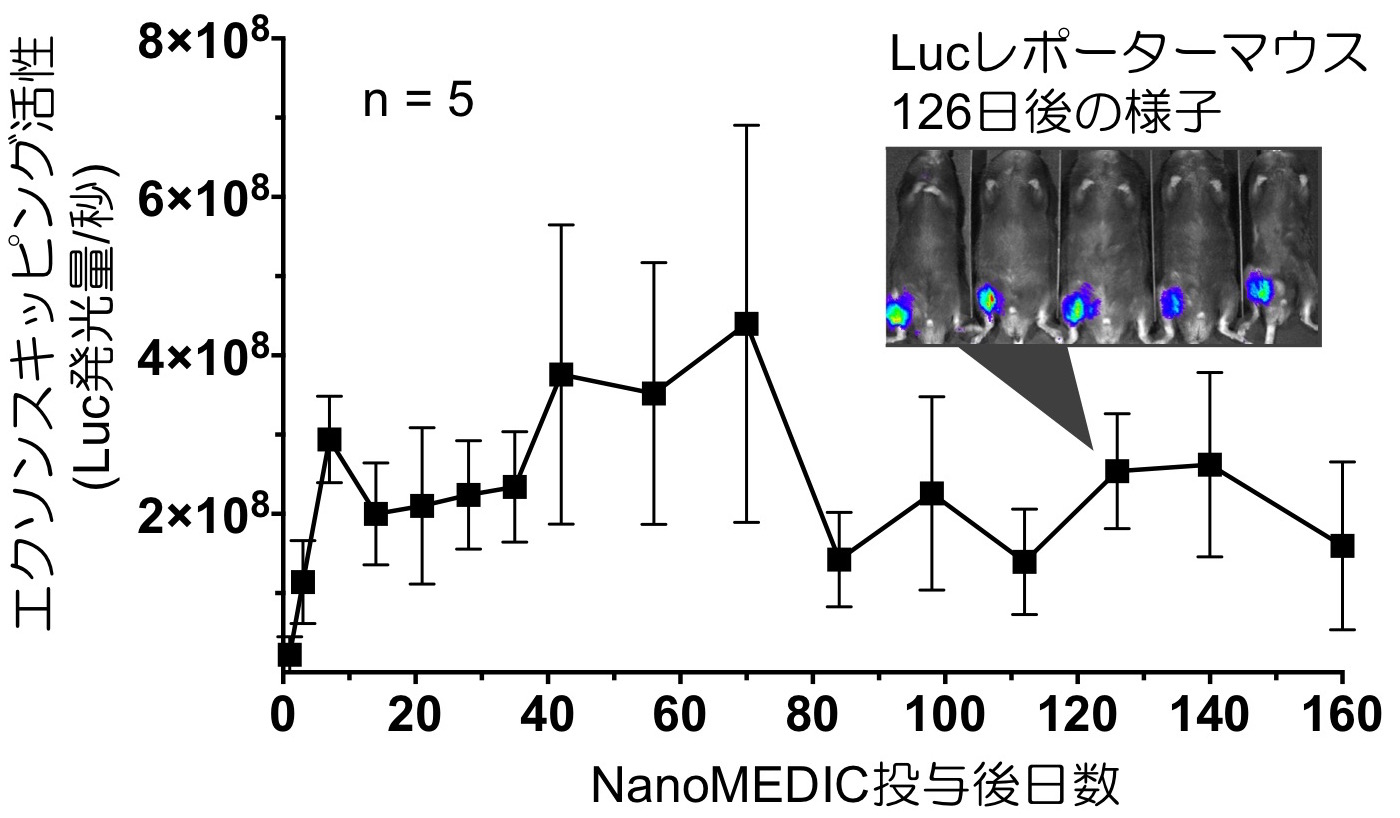
このNanoMEDICシステムはタンパク質ベースの送達技術なので、比較的大きなタンパク質でも搭載可能であると期待されます。また、数日以下の短いCas9活性誘導のため、オフターゲット変異導入リスクが低いのも特徴です。これらの優れた特性を生かし、筋ジストロフィーに対するゲノム編集治療法開発はもちろんのこと、様々なゲノム編集関連技術や遺伝子治療への応用が期待されます。
本研究成果はNature Communicationsで報告しました。 (Mar 13, 2020)
Gee P, Lung MSY, Okuzaki Y, Sasakawa N, Iguchi T, Makita Y, Hozumi H, Miura Y, Yang LF, Iwasaki M, Wang XH, Waller MA, Shirai N, Abe YO, Fujita Y, Watanabe K, Kagita A, Iwabuchi KA, Yasuda M, Xu H, Noda T, Komano J, Sakurai H, Inukai N, and .Extracellular nanovesicles for packaging of CRISPR-Cas9 protein and sgRNA to induce therapeutic exon skipping.
Nature Communications, 2020 Mar 13;. doi: 10.1038/s41467-020-14957-y.
[PubMed link] [Journal link]
国産CRISPR-Cas3システム開発
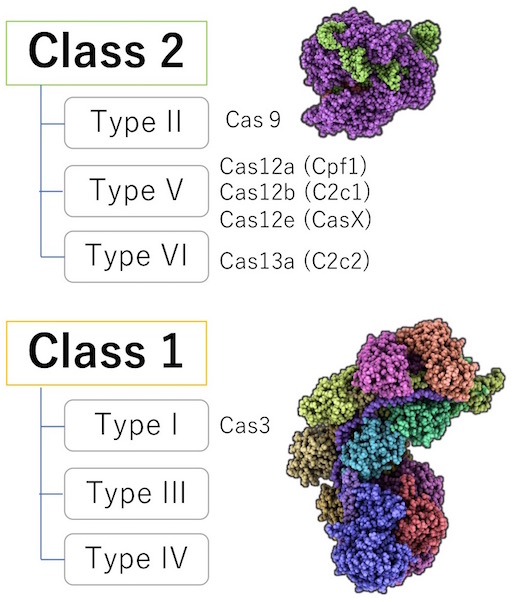 CRISPRクラス2のゲノム編集ツールは、最も汎用されているタイプⅡ Cas9を筆頭に、タイプⅤ Cas12 (Cpf1やC2C1, CasX等)や、RNAを標的とするタイプⅥ Cas13などが盛んに研究されています。一方で、Cas9は狙っていない場所に変異が入ってしまうオフターゲット変異リスクや、知的財産の問題があり、新しいゲノム編集ツールの開発が求められていました。
CRISPRクラス2のゲノム編集ツールは、最も汎用されているタイプⅡ Cas9を筆頭に、タイプⅤ Cas12 (Cpf1やC2C1, CasX等)や、RNAを標的とするタイプⅥ Cas13などが盛んに研究されています。一方で、Cas9は狙っていない場所に変異が入ってしまうオフターゲット変異リスクや、知的財産の問題があり、新しいゲノム編集ツールの開発が求められていました。
また自然界において、CRISPRシステムは細菌や古細菌の獲得免疫システムとして用いられていますが、クラス2は全体の10%程度の種でしか利用しておらず、他の90%の種ではクラス1を利用しています。これは、クラス1システムの方がクラス2システムと比較して、DNA切断活性や自己-非自己認識の特異性に優れているためと考えられます。
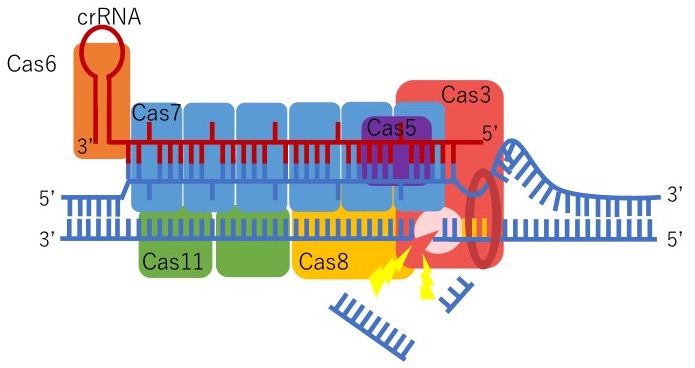 我々は、東京大学の真下知士先生、大阪大学の竹田潤二先生らとの共同研究により、新たにCRISPRクラス1に属する大腸菌由来タイプI-E CRISPR-Cas3システムをヒト細胞でのゲノム編集に利用するように成功しました。CRISPR-Cas3は、狙ったゲノム配列の上流側を大きく削るというユニークなゲノム編集特性を持ち、オフターゲット変異リスクもCas9に比べて低いことも明らかにしました。これは、Cas9のgRNAが20塩基を認識するのに対し、Cas3システムのcrRNAが27塩基を認識すること、およびCas3, Cas5, Cas6, Cas7, Cas8, Cas11が複合体を形成してはじめて作用することなどの特徴を備えているためと考えられます。
我々は、東京大学の真下知士先生、大阪大学の竹田潤二先生らとの共同研究により、新たにCRISPRクラス1に属する大腸菌由来タイプI-E CRISPR-Cas3システムをヒト細胞でのゲノム編集に利用するように成功しました。CRISPR-Cas3は、狙ったゲノム配列の上流側を大きく削るというユニークなゲノム編集特性を持ち、オフターゲット変異リスクもCas9に比べて低いことも明らかにしました。これは、Cas9のgRNAが20塩基を認識するのに対し、Cas3システムのcrRNAが27塩基を認識すること、およびCas3, Cas5, Cas6, Cas7, Cas8, Cas11が複合体を形成してはじめて作用することなどの特徴を備えているためと考えられます。
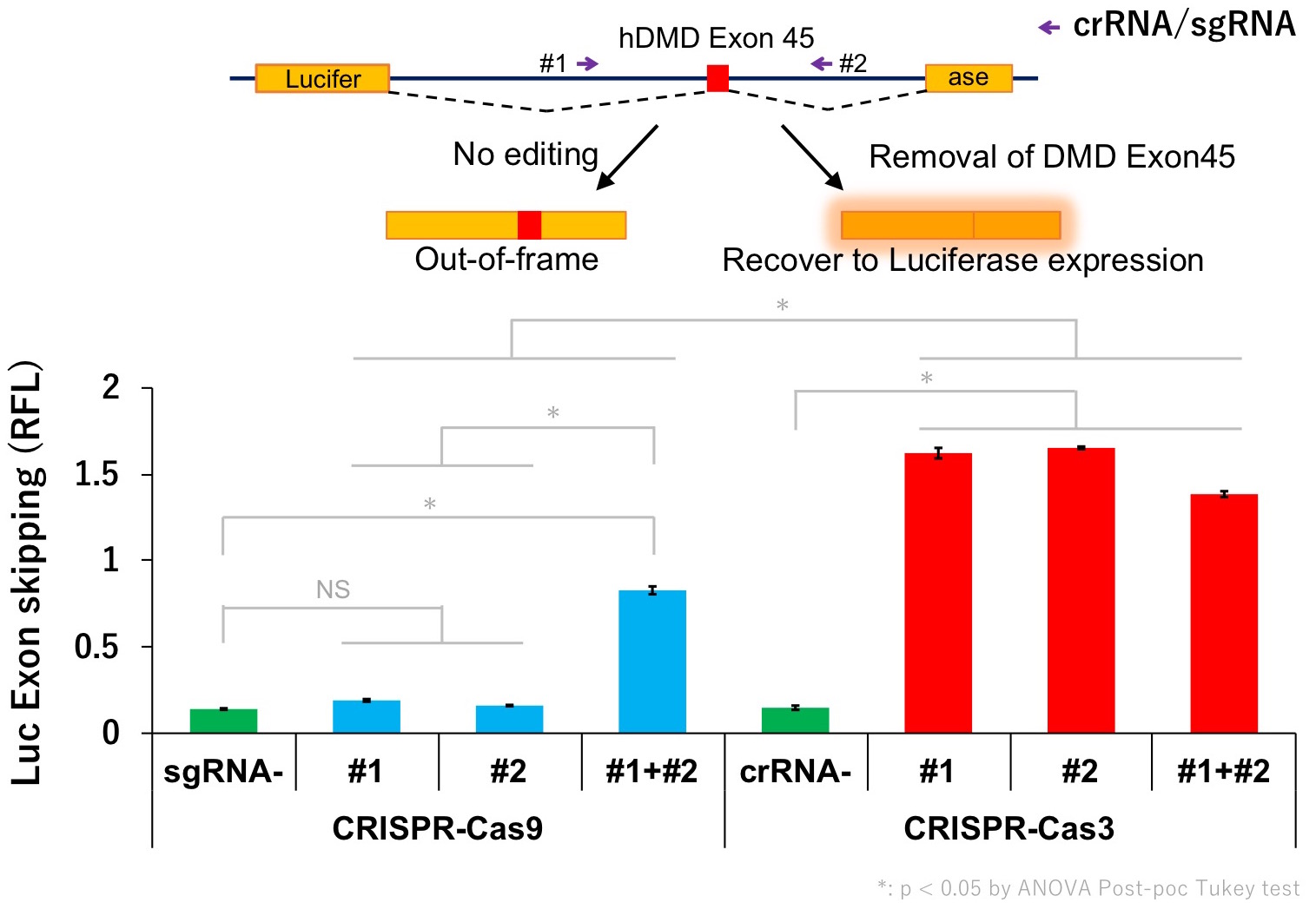 我々はさらに、デュシェンヌ型筋ジストロフィー患者由来のiPS細胞において、Cas3システムが一方向にゲノムDNAを大きく切除するという特性を利用して、ジストロフィン遺伝子の標的エクソンを削り取るエクソンスキッピングを誘導にも成功しました。エクソンスキッピングを誘導したiPS細胞を骨格筋に分化誘導すると、修復されたジストロフィンタンパク質がきちんと発現することも確認しました。また、大きなゲノム領域を削り取る能力は、Cas9で二箇所切断するよりも、Cas3一つの方が効率が良いことも分かりました。
我々はさらに、デュシェンヌ型筋ジストロフィー患者由来のiPS細胞において、Cas3システムが一方向にゲノムDNAを大きく切除するという特性を利用して、ジストロフィン遺伝子の標的エクソンを削り取るエクソンスキッピングを誘導にも成功しました。エクソンスキッピングを誘導したiPS細胞を骨格筋に分化誘導すると、修復されたジストロフィンタンパク質がきちんと発現することも確認しました。また、大きなゲノム領域を削り取る能力は、Cas9で二箇所切断するよりも、Cas3一つの方が効率が良いことも分かりました。
まだCas3システムの作用分子メカニズムについては不明な点も多く、今後のさらなる研究により、作用メカニズムの解明が期待されます。また今後、筋ジストロフィーのゲノム編集治療開発研究はもちろんのこと、そのユニークな特性を利用して様々な研究へと応用が期待されます。
本研究成果はNature Communicationsで報告しました。 (Dec 6, 2019)
 Morisaka H*, Yoshimi K*, Okuzaki Y*, Gee P, Kunihiro Y, Sonpho E, Xu H, Sasakawa N, Naito Y, Nakada S, Yamamoto T, Sano S, §, Takeda J§, and Mashimo T§. (*: Co-1st author, §: Co-correspondance)
Morisaka H*, Yoshimi K*, Okuzaki Y*, Gee P, Kunihiro Y, Sonpho E, Xu H, Sasakawa N, Naito Y, Nakada S, Yamamoto T, Sano S, §, Takeda J§, and Mashimo T§. (*: Co-1st author, §: Co-correspondance)CRISPR-Cas3 induces broad and unidirectional genome editing in human cells.
Nature Communications, 2019 Dec 6;10(1):5302. doi: 10.1038/s41467-019-13226-x.
[PubMed link] [Journal link]
※Top 50 Read Articles of 2019に選出!
HLAゲノム編集による細胞移植時の免疫拒絶回避
他人由来のiPS細胞を細胞治療に用いる際、細胞表面に存在するHLA(ヒト白血球抗原、またはMHC)タンパク質の"型"にミスマッチがあると、免疫拒絶の原因となります。HLAホモ接合体ドナー由来のiPS細胞を用いることによりHLA適合性を上げることが可能であり、iPS細胞研究所では既に、特に日本人で頻度の高いHLA型を持ったHLAホモiPS細胞の作製を進めています。日本人の90%以上をカバーするにはHLA-A,B,DRがホモ接合体であるiPS細胞株を140種類ほど用意する必要がありますが、そもそもHLA型をホモ接合体として持つ人は稀少であり、ドナー勧誘が律速となっていました。一方で、全てのHLAクラスIを細胞表面へと提示するのに必要なB2M遺伝子を破壊することで全てのHLAを欠失させる方法が報告されています。この方法ではキラーT細胞(CD8陽性)の拒絶を免れることはできますが、HLAを介したNK細胞を抑制する機能が損なわれてしまい、NK細胞には攻撃されてしまうことが知られています。加えて、HLA完全欠失細胞は、細胞内の抗原をキラーT細胞やヘルパーT細胞へ提示する能力も欠失してしまうため、感染リスクや腫瘍化時に免疫系に排除されないリスクも存在し、新たな方法が必要と考えました。
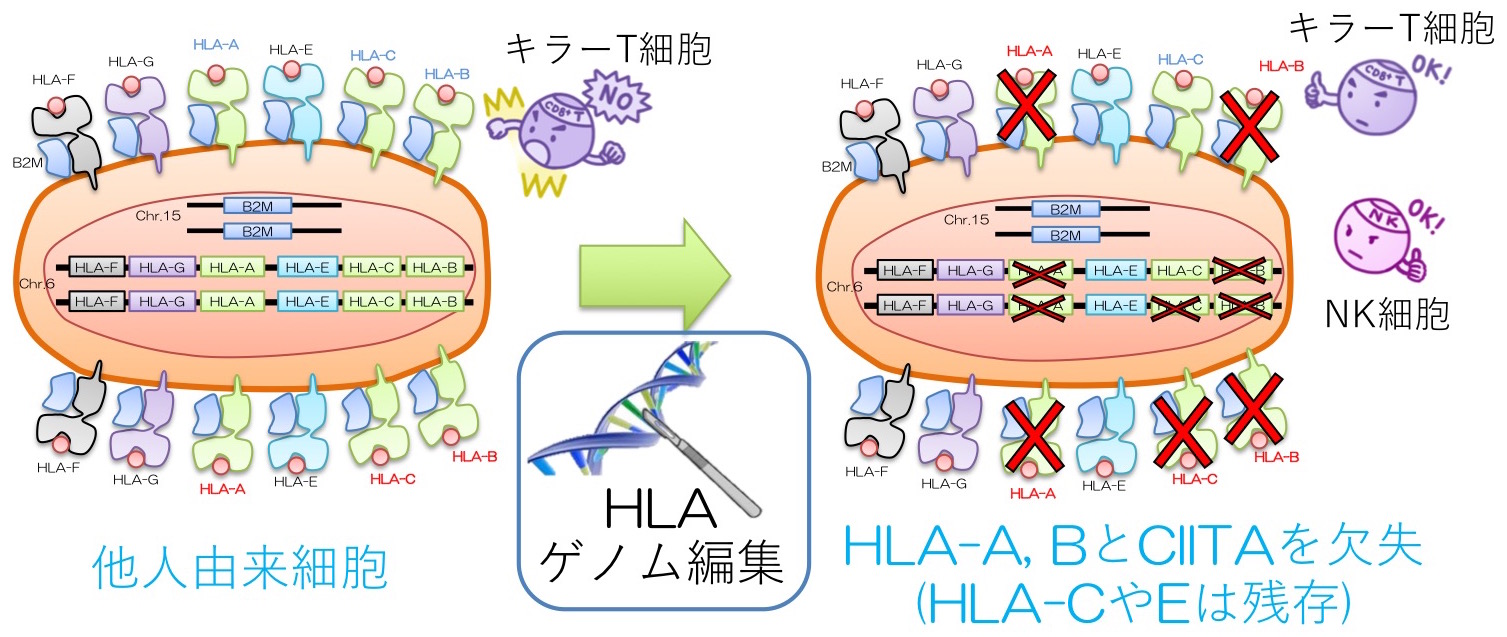 そこで我々は、古典的HLAクラスI (HLA-A,B,C)の中でNK細胞の抑制に最も重要なHLA-Cと非古典的HLA(HLA-E,F,G)を残存させつつ、残りのHLAをゲノム編集で欠失させた「HLA-C残存細胞」を作成しました。この方法では、まずHLA-A,Bを両アレル破壊後に、HLA-Cの片アレルを特異的にCRISPR-Cas9を用いてノックアウトしました。このHLA-C残存株を、残存したHLA-CのみHLA型が一致する仮想レシピエント由来のCD8陽性T細胞と混合した結果、HLA-C残存細胞はHLA編集前の細胞と比較してT細胞の攻撃を回避できることが示されました。続いて、仮想レシピエント由来のNK細胞と混合した結果、HLA-C残存細胞はB2M破壊細胞よりも明らかにNK細胞の攻撃を回避できることが分かりました。さらに、HLAクラスIIの転写制御因子であるCIITA遺伝子の欠失と組み合わせて”HLA-C残存 + クラスII欠損細胞”を作成し、仮想レシピエント由来の末梢血と混合した結果、CD8陽性T細胞、CD4陽性T細胞、NK細胞のいずれも活性化させないことが示されました。
そこで我々は、古典的HLAクラスI (HLA-A,B,C)の中でNK細胞の抑制に最も重要なHLA-Cと非古典的HLA(HLA-E,F,G)を残存させつつ、残りのHLAをゲノム編集で欠失させた「HLA-C残存細胞」を作成しました。この方法では、まずHLA-A,Bを両アレル破壊後に、HLA-Cの片アレルを特異的にCRISPR-Cas9を用いてノックアウトしました。このHLA-C残存株を、残存したHLA-CのみHLA型が一致する仮想レシピエント由来のCD8陽性T細胞と混合した結果、HLA-C残存細胞はHLA編集前の細胞と比較してT細胞の攻撃を回避できることが示されました。続いて、仮想レシピエント由来のNK細胞と混合した結果、HLA-C残存細胞はB2M破壊細胞よりも明らかにNK細胞の攻撃を回避できることが分かりました。さらに、HLAクラスIIの転写制御因子であるCIITA遺伝子の欠失と組み合わせて”HLA-C残存 + クラスII欠損細胞”を作成し、仮想レシピエント由来の末梢血と混合した結果、CD8陽性T細胞、CD4陽性T細胞、NK細胞のいずれも活性化させないことが示されました。
さらに、作成したHLA-C残しiPS細胞(HLA編集iPS細胞)を血球細胞に分化させ、マウスに移植した後に、HLA反応性のヒトT細胞を投与して、マウス体内で免疫拒絶を再現しました。その結果、ゲノム編集前のiPS細胞由来血球はヒトT細胞に攻撃されて排除されてしまったのに対し、ゲノム編集したiPS細胞の方はより長期により多くの細胞が生存することを確認できました。
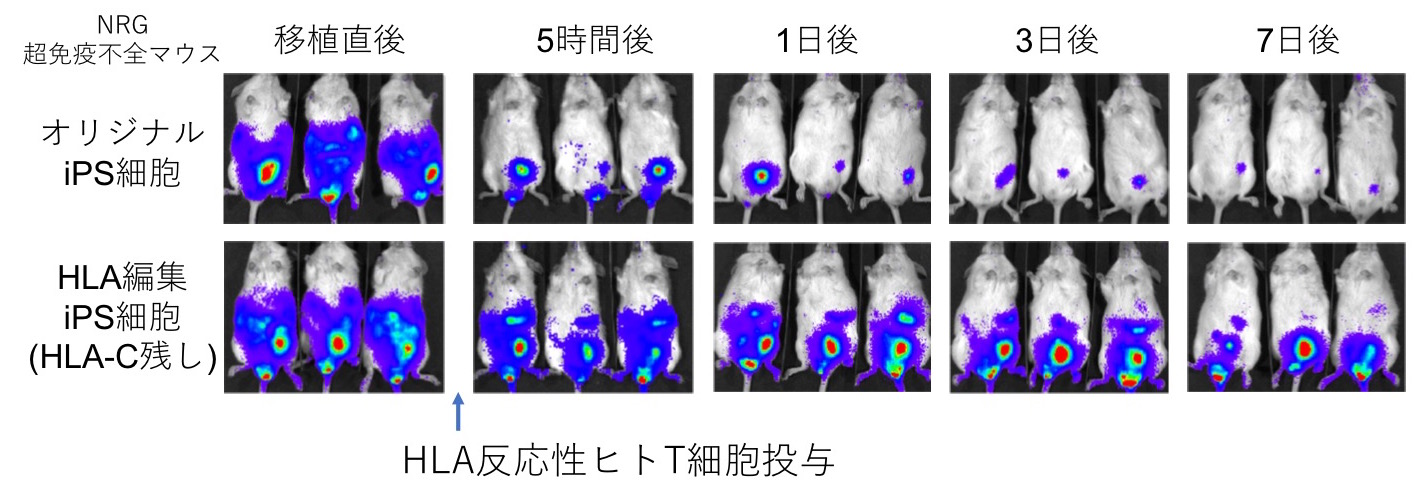
ゲノム編集を用いることにより、iPS細胞の免疫学的適合性を向上できることを示しました。”HLA-C残存 + クラスII欠損細胞”は、HLA-C型を適切に選択すれば、6株で日本人の9割以上を、12株で世界上の多くの民族の9割以上をカバーできると試算しています。一つのiPS細胞株がより多くの患者さんで使用できるようになれば、その分、一株辺りの製造コストも下がることになるので、iPS細胞を利用した細胞治療を普及させるために、特に有用性が高い技術であると考えています。
本研究成果はCell Stem Cellで報告しました。 (Mar 7, 2019)
 Xu H*, Wang B*, Ono M, Kagita A, Fujii K, Sasakawa N, Ueda T, Gee P, Nishikawa M, Nomura M, Kitaoka F, Takahashi T, Okita K, Yoshida Y, Kaneko S§, and §. (*: Co-1st author, §: Co-correspondance)
Xu H*, Wang B*, Ono M, Kagita A, Fujii K, Sasakawa N, Ueda T, Gee P, Nishikawa M, Nomura M, Kitaoka F, Takahashi T, Okita K, Yoshida Y, Kaneko S§, and §. (*: Co-1st author, §: Co-correspondance)Targeted Disruption of HLA Genes via CRISPR-Cas9 Generates iPSCs with Enhanced Immune Compatibility.
Cell Stem Cell, 2019 Mar 7;. doi: 10.1016/j.stem.2019.02.005.
[PubMed link] [Journal link]
※雑誌表紙に選出!Best of Cell Stem Cellに選出!Web of Science Highly Cited in Field論文に選出!
筋ジストロフィーiPS細胞でのゲノム編集治療法開発
デュシェンヌ型筋ジストロフィーはジストロフィン遺伝子の異常によって引き起こされる先天性の進行性筋萎縮症です。ジストロフィン遺伝子は220万塩基もの長さがある巨大な遺伝子であり、途中にDNAの欠損が起きると、フレームシフトが起こりタンパク質が途中で途切れてしまいます。我々はジストロフィンタンパク質の全長を回復するために、TALENあるいはCRISPRと呼ばれる人工ヌクレアーゼ(DNAのメス)を利用して遺伝子を修復する研究を行っています。
我々はまず、ヒトゲノム配列をコンピューター上でサーチして、ヒトゲノム上に一箇所しなかい10-16塩基長の短いDNA配列だけを抽出し、iGEATsデータベースを作製しました。このデータベースを用いる事で、TALENやCRISPRの認識配列が、ヒトゲノム上の一箇所だけを特異的にターゲットできる領域を見つけ易くしました。次に、筋ジストロフィー患者からiPS細胞を作製し、3通りの戦略を用いてジストロフィン遺伝子の変異を修復できることを示しました。さらに、TALENとCRISPRで修復効率を調べた所、どちらも遜色無い事が分かりました。さらには、遺伝子修復を行ったiPS細胞において、染色体の核型やDNAのコピー数変異、そしてタンパク質コード領域の塩基変異を解析した所、目立った致命的な変異は発見されませんでした。この結果は、TALENやCRISPRを正しくデザイン構築ができれば、iPS細胞においてほとんど副作用無く遺伝子修復が行えることを示しています。
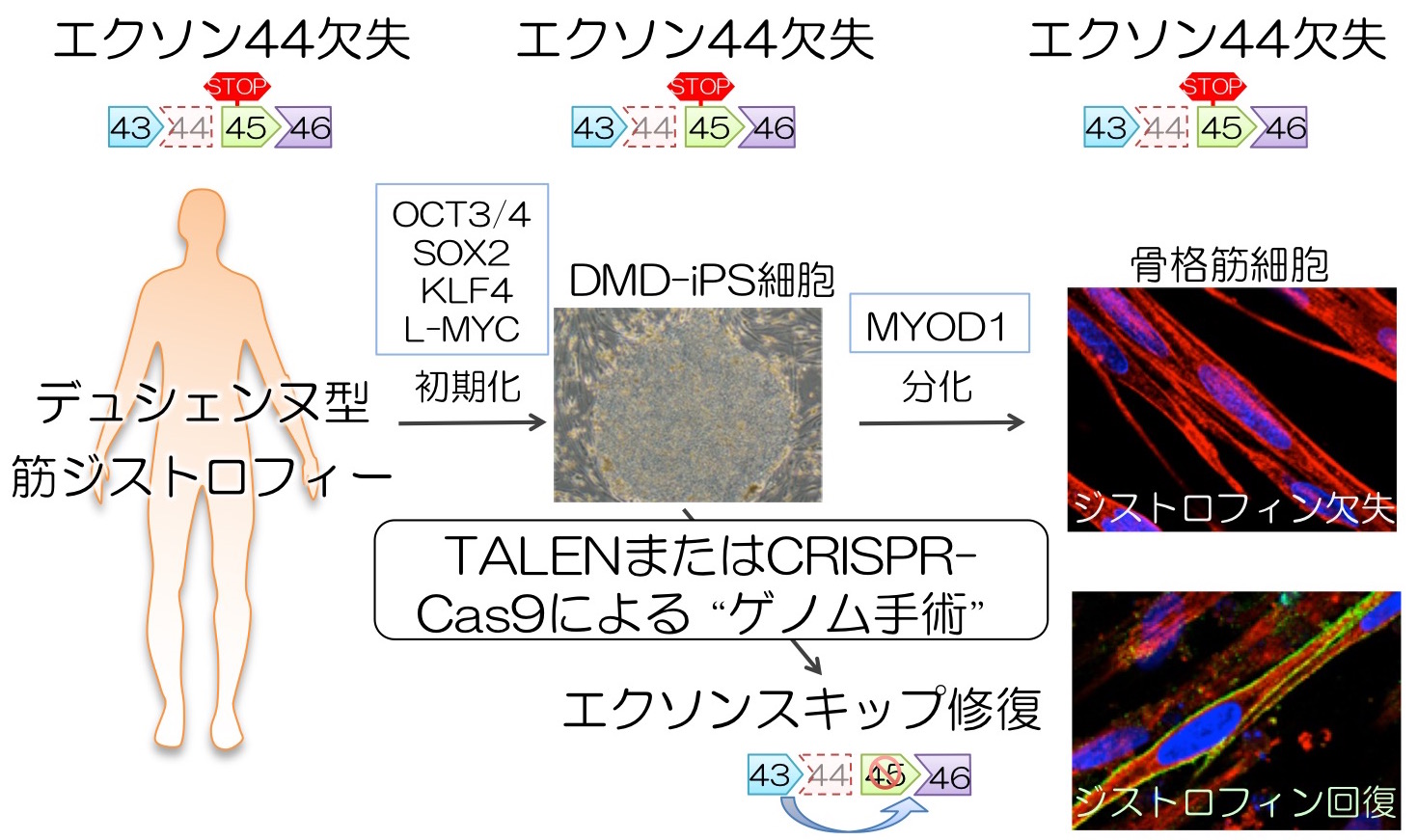
最後に、修復iPS細胞を筋肉細胞に分化させた所、患者由来の修復前iPS細胞ではジストロフィンタンパク質の発現が見られなかったのに対し、遺伝子修復後のiPS細胞ではジストロフィン遺伝子の局在およびサイズが健常人と同レベルまで回復していることを確認しました。この成果は、デュシェンヌ型筋ジストロフィーに対する全く新しい遺伝子治療の方法となることが期待されます。
本研究成果はStem Cell Reportsで報告しました。 (Nov 26, 2014)
 Li HL, Fujimoto N, Sasakawa N, Shirai S, Ohkame T, Sakuma T, Tanaka M, Amano N, Watanabe A, Sakurai H, Yamamoto T, Yamanaka S, and
Li HL, Fujimoto N, Sasakawa N, Shirai S, Ohkame T, Sakuma T, Tanaka M, Amano N, Watanabe A, Sakurai H, Yamamoto T, Yamanaka S, and
Precise correction of the Dystrophin gene in Duchenne muscular dystrophy patient induced pluripotent stem cells by TALEN and CRISPR-Cas9.
Stem Cell Reports, 2015; Vol.4 (1): p143-154. [PubMed link] [Journal link]
Best of Stem Cell Reportsに選出!Web of Science Highly Cited in Field論文に選出!
EOS多能性レポーターによるヒトiPS細胞誘導の効率化 (2009年)
体細胞に数種類の転写因子を導入することで作り出されるiPS細胞は、ES細胞と同等の分化能力を持つことから、分化多能性の研究、難病の発病機構の研究や治療法の開発、さらには再生医療への応用などが期待されています。しかしながら、ヒトiPS細胞の誘導効率は低く(〜0.02%)、また株によって分化多能性や品質にばらつきがあることが知られています。
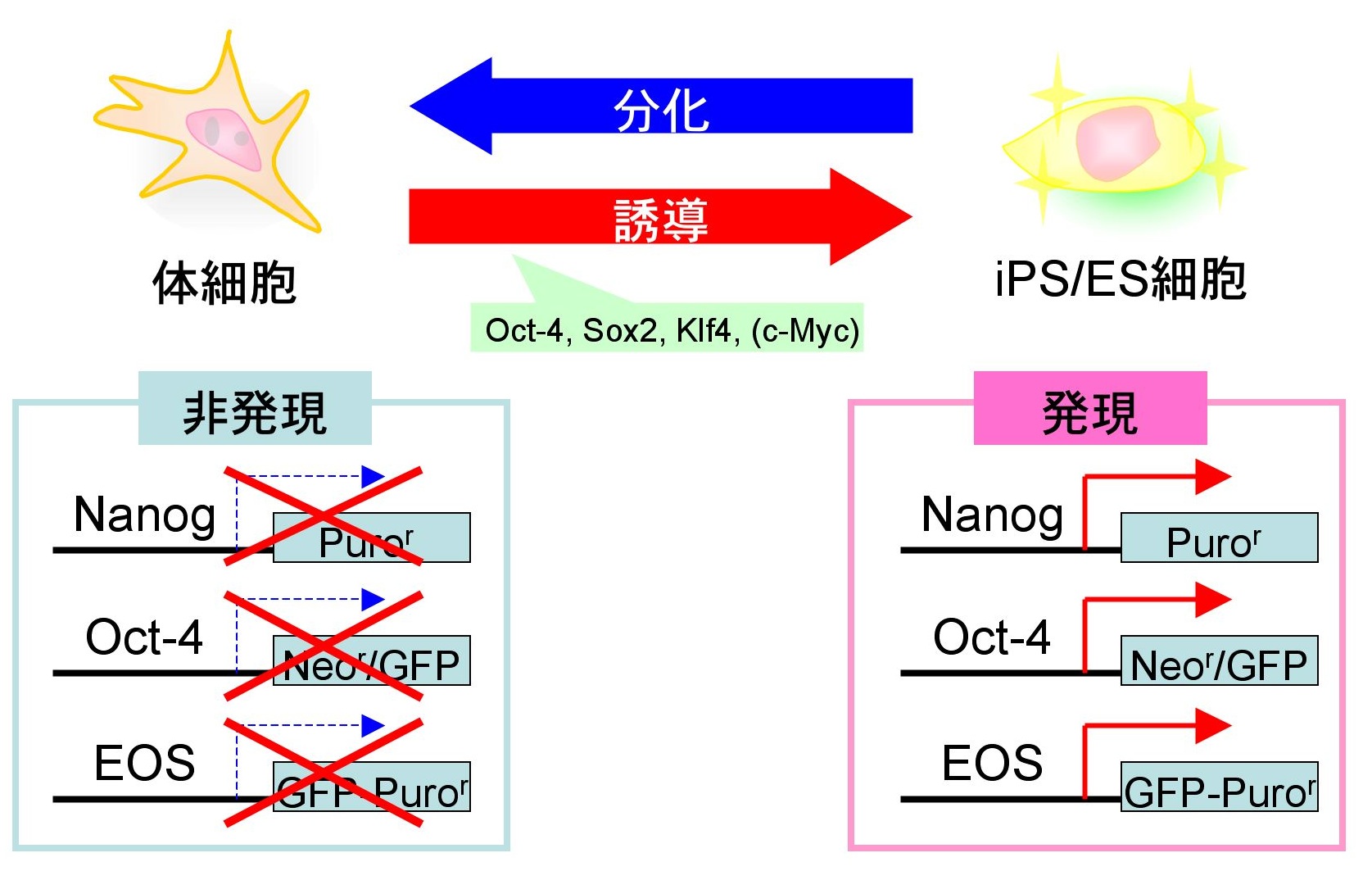 そこで、より効率的で、しかもより均質なヒトiPS細胞樹立方法の開発を目指して、GFP(緑色蛍光タンパク質)などの目印となる遺伝子をES/iPS細胞だけで発現するレンチウイルスベクターの開発を行いました。マウス初期胚や未分化ES細胞で高発現しているEarly Transposon (ETn)由来のプロモーターに、Oct-4 (別名Pou5f1)のエンハンサー領域を三量化して連結することで、未分化な多能性幹細胞だけで特異的に発現するEOSレンチウイルスベクターの開発に成功しました。(Hotta et al., Nature Methods, 2009)
そこで、より効率的で、しかもより均質なヒトiPS細胞樹立方法の開発を目指して、GFP(緑色蛍光タンパク質)などの目印となる遺伝子をES/iPS細胞だけで発現するレンチウイルスベクターの開発を行いました。マウス初期胚や未分化ES細胞で高発現しているEarly Transposon (ETn)由来のプロモーターに、Oct-4 (別名Pou5f1)のエンハンサー領域を三量化して連結することで、未分化な多能性幹細胞だけで特異的に発現するEOSレンチウイルスベクターの開発に成功しました。(Hotta et al., Nature Methods, 2009)
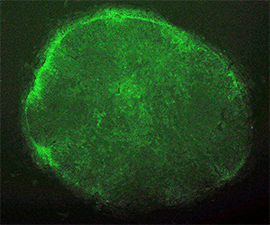 このEOSベクターをヒト線維芽細胞へ導入した際にはGFPは発現しませんが、そこへ山中教授の発見された四種類の転写因子(OCT-4, SOX2, KLF4, C-MYC)を導入してiPS細胞の誘導を行うと、EGFPの発現が活性化され、緑の蛍光を発することを確認しました。さらに選択用の薬剤(ピューロマイシン)を添加することで、ヒトES細胞様のiPS細胞コロニーだけが選択的に増殖し、ヒトES細胞マーカー(TRA-1-81等)を発現する細胞の割合を70%以上にまで高めることが可能となりました。また、この方法を用いてレット症候群(MeCP2遺伝子の異常で起こる進行性の神経疾患)患者由来のiPS細胞樹立にも成功しました。このEOSベクターは、リプログラミングされたiPS細胞を特異的に選択するだけでなく、新しい多能性幹細胞の性質であるNaive型のヒトiPS細胞の誘導方法最適化や小分子化合物の探索等にも利用されています。
このEOSベクターをヒト線維芽細胞へ導入した際にはGFPは発現しませんが、そこへ山中教授の発見された四種類の転写因子(OCT-4, SOX2, KLF4, C-MYC)を導入してiPS細胞の誘導を行うと、EGFPの発現が活性化され、緑の蛍光を発することを確認しました。さらに選択用の薬剤(ピューロマイシン)を添加することで、ヒトES細胞様のiPS細胞コロニーだけが選択的に増殖し、ヒトES細胞マーカー(TRA-1-81等)を発現する細胞の割合を70%以上にまで高めることが可能となりました。また、この方法を用いてレット症候群(MeCP2遺伝子の異常で起こる進行性の神経疾患)患者由来のiPS細胞樹立にも成功しました。このEOSベクターは、リプログラミングされたiPS細胞を特異的に選択するだけでなく、新しい多能性幹細胞の性質であるNaive型のヒトiPS細胞の誘導方法最適化や小分子化合物の探索等にも利用されています。
本研究成果は Nature Methodsで報告しました。(April 26, 2009)
, Cheung, AY, Farra, N, Vijayaragavan, K, Seguin, CA, Draper, JS, Pasceri, P, Maksakova, IA, Mager, DL, Rossant, J, Bhatia, M, Ellis, J.Isolation of human iPS cells using EOS lentiviral vectors to select for pluripotency.
Nature Methods, 2009; Vol.6 (5): p370-376. [PubMed link] [Journal link]
※雑誌表紙に選出!